Voila Comment Interpréter Un Résultat Positif de COVID-19 Par la RT-PCR et la Sérologie
La pandémie de coronavirus 2019 est devenue un sérieux problème de santé public mondiale. Les tests de diagnostic de ce nouveau virus (SRAS-CoV-2) évoluent toujours, et une compréhension claire de la nature des tests avec l’interprétation de leurs résultats est primordiale. Dans cet article on va vous montrer comment interpréter 2 types de tests de diagnostic qui sont couramment utilisés pour le COVID-19 : La RT- PCR (Retro Transcriptase Polymeras Chain Reaction) et le Test Sérologiques ELISA.
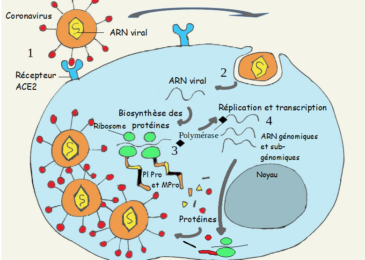
Détection d’ARN viral par RT-PCR
Jusqu’à présent, le test le plus couramment utilisé et le plus fiable pour le diagnostic de COVID-19 est le test RT-PCR réalisée à partir des écouvillons nasopharyngés ou d’autres Prélèvements des voies respiratoires supérieures, y compris un écouvillonnage de la gorge ou, plus récemment la salive. Une variété d’amorces d’ARN sont utilisées par différents fabricants, la plupart des tests ciblant un ou plusieurs gènes de l’enveloppe (env), nucléocapside (N), La protéine Spike (S), l’ARN polymérase (RdRp) et les gènes ORF1. Les sensibilités des tests aux gènes individuels sont comparables selon des études comparatives, à l’exception de la sonde d’amorçage RdRpSARSr qui a une légère sensibilité plus faible.
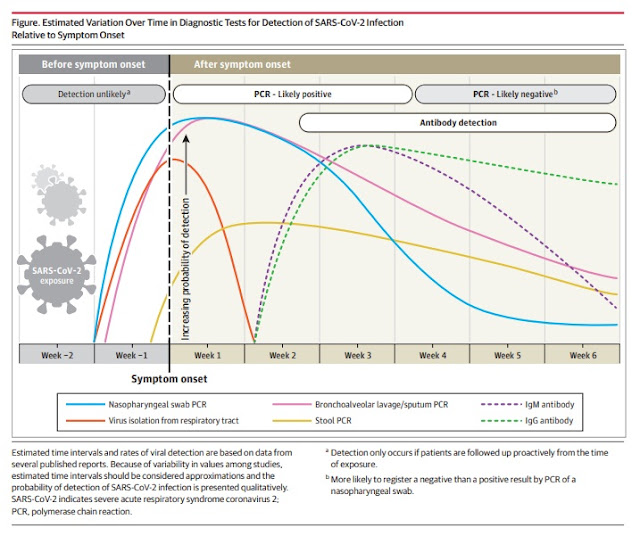
Chez la plupart des personnes atteintes de COVID-19 symptomatique, L’ARN viral dans les échantillons nasopharyngé est mesuré par un nombre de cycle seuil et devient détectable dès le premier jour d’apparition des symptômes et atteint le pic dans la première semaine d’apparition des symptômes. Le cycle seuil (CS) est le nombre de cycles de réplication nécessaires pour produire un signal fluorescent.
Les valeurs inférieures de CS représentent une charge virale élevée. Une valeur CS inférieure à 40 égales une PCR positive. Cette positivité commence à diminuer à la Troisième semaine et devient par la suite indétectable.
La positivité à la PCR peut persister au-delà de 3 semaines après l’apparition de la maladie chez les patients gravement malades.
Il faut signaler qu’un résultat de PCR «positif» Permet uniquement confirmer la détection de l’ARN viral et ne signifie pas nécessairement la présence d’un virus viable dans l’organisme.
Dans certains cas, l’ARN viral a été détecté par RT-PCR même au-delà de la sixième semaine après le premier test positif. Quelques cas ont également été signalés positifs après 2 tests PCR négatifs consécutifs effectués 24 heures d’intervalle. Il n’est pas clair s’il s’agit d’une erreur de test, d’une réinfection ou d’une réactivation du virus. Dans une étude de 9 patients, les tentatives d’isolement du virus en culture ont échoué au-delà du huitième jour de début de la maladie, ce qui est corrèle avec le déclin de l’infectiosité au-delà de la première semaine.
C’est pourquoi la «stratégie basée sur les symptômes» adopté par le (CDC) indique que les professionnels de la santé peuvent retourner au travail, si «au moins 3 jours (72 heures) se sont écoulés depuis le rétablissement définitif, avec une amélioration des symptômes respiratoires (par exemple, toux, essoufflement) et disparition de la fièvre; et, au moins 10 jours après l’apparition des premiers symptômes.
La chronologie de la positivité de la PCR est différente selon la nature des échantillons. La Positivité de la PCR diminue plus lentement dans les expectorations et peut toujours être positif après que les prélèvements nasopharyngés sont négatifs. La une positivité à la PCR dans les selles a été observée chez 57% des patients infectés.
Dans une étude portant sur 205 patients avec Infection à COVID-19, la positivité à la RT-PCR était la plus élevée dans les échantillons de lavage broncho-alvéolaire (93%), suivis par crachats (72%), écouvillonnage nasal (63%) et écouvillonnage pharyngé (32%).5 Les résultats faussement négatifs se sont principalement produits en raison d’un moment inapproprié pour la collecte des échantillons en relation avec le début de la maladie et le choix du site du prélèvement, en particulier des écouvillons nasopharyngés.
La spécificité de la plupart des tests RT-PCR est de 100% parce que la conception de l’amorce est spécifique à la séquence du génome de SARS-CoV-2.
Des résultats faux positifs occasionnels peuvent se produire en raison d’erreurs techniques et de contamination des réactifs.
Cela nous permet de dire que la réalisation de la technique RT PCR nécessite un équipement adéquat et sophistiqué et des réactifs validé et des personnels bien formé.
Détection des anticorps dirigés contre le SARS-CoV-2
L’infection au COVID-19 peut également être détectée indirectement en mesurant la réponse immunitaire de l’hôte à l’infection par SARS CoV-2. Le diagnostic sérologique est surtout important pour les patients atteints d’une maladie légère à modérée qui peut se présenter tard, au-delà des 2 premières semaines du début de la maladie. Le diagnostic sérologique devient également un outil important pour comprendre l’étendue de COVID-19 dans la communauté et d’identifier les individus qui sont immunisés et potentiellement «protégés» contre l’infection.
Le marqueur sérologique le plus sensible et le plus précoce est le total des anticorps IgM+IgG, dont les niveaux commencent à augmenter la deuxième semaine d’apparition des symptômes. Bien que les IgM et Les tests ELISA IgG se sont révélés positifs dès le début comme le quatrième jour après l’apparition des symptômes, des niveaux plus élevés se produisent au cours des deuxième et troisième semaines de maladie.
Par la suite, l’IgM commence à décliner et atteint un bas niveau à la Cinquième semaine et disparaît presque à la septième semaine. Alors que l’IgG persiste au-delà de 7 semaines.
Les tests IgM et IgG basés sur ELISA ont plus de 95% de spécificité pour le diagnostic de COVID-19. En règle générale, la majorité des anticorps sont produits contre la protéine la plus abondante du virus, qui est le NC. Par conséquent, les tests qui détectent les anticorps contre NC seraient le plus sensible. Cependant, la liaison au récepteur le domaine de la protéine S (RBD-S) est la protéine de fixation de l’hôte, et les anticorps anti-RBD-S seraient plus spécifiques et devraient être neutralisant donnant une immunité de l’hôte contre le virus. Par conséquent, l’utilisation d’un ou des deux antigènes pour la détection des IgG et IgM entraînerait une sensibilité élevée.
Cependant Les anticorps détectés peuvent avoir une réactivité croisée avec le SRAS-CoV et éventuellement autres coronavirus.
Des tests rapides pour la détection des anticorps ont largement développés et commercialisés et sont de qualité variable. De nombreux fabricants ne révèlent pas la nature des antigènes utilisés. Ces tests sont de nature purement qualitative et ne peuvent qu’indiquer la présence ou l’absence d’anticorps anti-SRAS-CoV-2. Des titres élevés d’anticorps IgG détectés par ELISA se sont révélés corréler positivement avec des anticorps neutralisants. La persistance à long terme de protection conférée par les anticorps neutralisants reste inconnue.