Introduction aux antiviraux
La chimiothérapie antivirale a connu un développement lent en raison de deux caractéristiques intrinsèques des virus : leur incapacité à s’autorépliquer de façon autonome et leur parasitisme intracellulaire strict. Ces particularités rendent difficile la mise au point de molécules capables d’inhiber la réplication virale sans affecter le métabolisme cellulaire normal.
L’efficacité d’un antiviral repose sur un index thérapeutique élevé, défini comme le rapport entre la dose toxique pour la cellule et la dose inhibitrice de la multiplication virale.
La stratégie thérapeutique dépend du type d’infection virale :
- Infection aiguë (ex. poliovirus)
- Infection latente avec réactivations (ex. virus Herpes simplex)
- Infection chronique (ex. VIH, VHC)
Malgré des succès notables, la chimiothérapie antivirale reste limitée par :
- La cytotoxicité liée à l’interférence avec le métabolisme cellulaire
- La variabilité génétique des virus et l’apparition de résistances
- L’impossibilité d’éradiquer totalement les infections virales latentes
Cibles des antiviraux dans le cycle de réplication virale
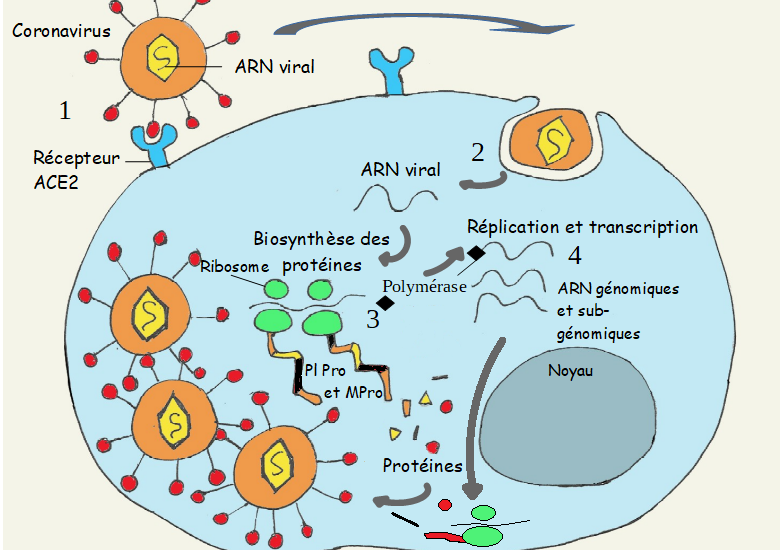
Le cycle de réplication virale comprend six étapes majeures, chacune constituant une cible potentielle pour les antiviraux :
- Attachement du virus aux récepteurs cellulaires
- Pénétration (endocytose ou fusion)
- Décapsidation
- Réplication du génome viral
- Assemblage et maturation
- Libération des virions néoformés
Ce livre est excellent pour bien comprendre la virologie d’une façon simple et facile. je vous le recommande vivement.
Antiviraux agissant sur l’attachement viral
Ces molécules empêchent la fixation du virus à la cellule hôte par saturation des récepteurs :
- Oligopeptides mimant l’hémagglutinine des virus de la grippe
- Oligopeptides mimant la gp120 du VIH
Antiviraux inhibant la pénétration virale
Virus de la grippe
La protéine virale M2 joue un rôle clé dans la pénétration et la décapsidation du virus influenza A. L’amantadine bloque les canaux ioniques formés par M2, empêchant l’acidification nécessaire à la réplication virale.
- Active uniquement sur les virus influenza A
- Utilisation prophylactique principalement
- Effets indésirables neuropsychiques fréquents
VIH
La pénétration du VIH implique plusieurs étapes et protéines cibles :
- Inhibiteurs de la liaison au CD4 (ex. PRO-542)
- Inhibiteurs des corécepteurs CCR5 (ex. SCH-C, PRO-140)
- Inhibiteurs du CXCR4 (ex. AMD3100)
- Inhibiteurs de la fusion (T20, T1249)
Ces molécules réduisent efficacement la charge virale, souvent en association avec d’autres antirétroviraux.
Antiviraux bloquant la décapsidation
Rhinovirus
La décapsidation des rhinovirus dépend de la protéine VP1. Des molécules comme l’arildone se fixent dans une dépression structurale de la capside, stabilisant excessivement le virus et empêchant la libération du génome viral. Leur efficacité clinique reste toutefois controversée.
Antiviraux inhibant la réplication virale
Principe général
Les antiviraux ciblent préférentiellement des enzymes virales absentes ou peu actives dans les cellules non infectées, assurant une meilleure spécificité.
Chimiothérapie antiherpétique
Les analogues nucléosidiques constituent la base du traitement des infections à Herpesviridae :
- Acyclovir / Valaciclovir : inhibition sélective de l’ADN polymérase virale
- Ganciclovir : actif sur le CMV, toxicité hématologique
- Foscarnet : utilisé en cas de résistance, toxicité rénale
- Vidarabine et idoxuridine : usage limité par la toxicité
Chimiothérapie anti-VIH
- Inhibiteurs nucléosidiques de la transcriptase inverse (INRT) : zidovudine, lamivudine, abacavir
- Inhibiteurs non nucléosidiques de la RT (INNRT) : efavirenz, nevirapine
- Apparition fréquente de résistances par mutations de la RT
Antiviraux agissant sur l’assemblage et la libération
VIH
Les inhibiteurs de la protéase empêchent la maturation des virions :
- Saquinavir, ritonavir, indinavir, nelfinavir
- Forte réduction de la charge virale et des infections opportunistes
Virus de la grippe
Les inhibiteurs de la neuraminidase (zanamivir, oseltamivir) bloquent la libération des virions et sont actifs sur les grippes A et B.
Évaluation de l’activité antivirale
Tests in vitro
- Mesure de la concentration inhibitrice (CI50, CI90, CI95)
- Étude des associations médicamenteuses (synergie, antagonisme)
Évaluation in vivo
Pour le VIH, l’efficacité est évaluée par la diminution et la persistance de la réduction de la charge virale plasmatique.
Limites de la chimiothérapie antivirale
Résistance antivirale
Favorisée par :
- Doses insuffisantes
- Traitements prolongés
- Forte variabilité génétique virale
Chez les Herpesviridae, les mécanismes incluent des anomalies de la thymidine kinase ou de l’ADN polymérase.
Cytotoxicité
Certains antiviraux présentent une toxicité importante, notamment chez les patients immunodéprimés ou en cas d’associations médicamenteuses.
Latence virale
Les antiviraux sont inefficaces sur les virus en phase latente. Les recherches actuelles visent la prévention de la latence et des réactivations.
Avenir de la chimiothérapie antivirale
- Développement de nouveaux analogues nucléosidiques plus spécifiques
- Études structure-fonction des enzymes virales
- Oligonucléotides antisens
- Photoinactivation virale (VIH, VHC)
Conclusion
Les antiviraux représentent une avancée majeure dans le traitement des infections virales. Malgré les défis liés à la résistance, à la toxicité et à la latence, les progrès en biologie moléculaire ouvrent la voie à des traitements plus ciblés, plus efficaces et mieux tolérés.