Myélo : du grec «muelos» = moelle
Gramme : du grec «gramma» = lettre, écriture et par extension, enregistrement écrit
Myélogramme ou médullogramme
« Le myélogramme est une étude cytologique quantitative (numérique) et qualitative (morphologique) du tissu hématopoïétique obtenu par ponction aspiration ».
Il permet :
d’évaluer la cellularité globale de la moelle osseuse,
de réaliser une analyse qualitative des cellules médullaires,
d’apprécier la répartition des différentes lignées et la maturation cellulaire au sein de chaque lignée (décompte différentiel).
1. L’intéret d’un Myélogramme
C’est un examen hématologique très demandé
Myélogramme est un acte médical réalisé dans:
un but diagnostique +++ : pathologies bénignes et malignes
un but pronostique : pathologies malignes
pour la surveillance des hémopathies malignes
2. les indications
Devant des signes cliniques tels que:
- Fièvre isolée ou persistante
- Adénopathies
- Splénomégalie… sans causes évidentes
Devant des anomalies radiologiques ( Anomalies osseuses particulières)
Devant des anomalies biologiques :
- Anémie normo ou macrocytaire arégénérative,
- neutropénie non expliqués,
- Pancytopénie
- Thrombopénie,
- Hyperleucocytoses,
- Blastes circulants ………..
- Anomalies d’électrophorèse des protéines sériques
- vitamines B12, ac. Folique diminués …
Dans le cadre d’un bilan d’extension:
- Tumeurs solides,
- Lymphomes malins,
- Maladie de Hodgkin……
- N.B : le myélogramme est indiqué chaque fois qu’une cause centrale est suspectée
3.Méthodologie
Le prélèvement
Il s’agit d’une ponction-aspiration de la moelle osseuse.
Chez l’adulte, la ponction se réalise au niveau du sternum, mais parfois également dans l’os iliaque (massifs postérieurs, épines iliaques antéro-supérieures, crête) et plus rarement aux épines vertébrales.
Chez l’enfant, on préfère les os iliaques, et chez le nouveau-né, la face antéro-interne du tibia.
La ponction peut être ou non précédée d’une anesthésie locale.
Les précautions d’asepsie rigoureuse doivent êtres prises .
Il existe de nombreux modèles de trocarts de ponction, mais le plus souvent utilisé est le trocart de Mallarmé.
Le liquide aspiré est toujours un mélange de moelle et de sang :
un prélèvement riche en grumeaux sera étalé tel quel sur les lames de verre
plus pauvre, on pourra retirer rapidement les quelques grains, les isoler et les étaler sur une lame comme pour des frottis sanguins.
Les lames sont séchées sur place à l’air libre, non fixées, puis transmises au laboratoire.
La ponction de la moelle osseuse n’a pas de véritable contre-indication (éviter de prélever lors des coagulopathies sévères)
Conditions d’envoi
les lames doivent être envoyées au laboratoire munies d’une fiche de renseignements complètes rédigée par le prescripteur (âge, renseignements cliniques, traitement en cours, les antécédents…)
Un prélèvement sanguin sur EDTA doit accompagner la demande de myélogramme (hémogramme/frottis sanguin/taux de réticulocytes)
Au laboratoire
Etiquetage des frottis médullaires
Colorations : Wright – MGG++++
Dans certains cas: colorations spéciales
La coloration de Perls (syndromes myélodysplasiques)
les réactions à la myélopexoxydases, estérases… (Leucémies aigues)
4. Myélogramme : Lecture
Les cellules souches ne sont pas identifiables morphologiquement.
Les cellules reconnaissables sur myélogramme sont les :
Précurseurs
Cellules matures
La lecture du myélogramme comporte trois temps successifs, tous trois indispensables:
Examen au faible grossissement pour l’appréciation générale des frottis
Examen au fort grossissement pour l’appréciation cytologique générale (aspect qualitatif)
Et enfin le décompte des éléments cellulaires (toujours au fort grossissement) = myélogramme
Faible grossissement (× 10) :
Toujours débuter par un examen au petit objectif, en insistant particulièrement sur l’étude des franges et des bords du frottis
Il permet :
D’apprécier la richesse médullaire : en cellules et en mégacaryocytes, faciles à repérer au petit grossissement (grande taille, petit nombre).
Juger de l’aspect homogène ou non des cellules des frottis : dans une moelle normale, toutes les cellules sont morphologiquement différentes = aspect hétérogène; dans une moelle envahie (par exemple leucémie aiguë), les cellules peuvent être toutes identiques = aspect homogène, monotone
Repérer des cellules normales rares mais de grande taille à ce grossissement (ostéoclastes, ostéoblastes, histiocytes et mastocytes)
En pathologie, il permet de déceler un envahissement par des cellules anormales, par exemple des cellules métastatiques (séparés ou syncytium), des cellules de surcharge constitutionnelle ou des histiocytes hémophagocytants.
Permet de choisir les frottis les plus riches et les zones les mieux étalées.
La richesse médullaire : plusieurs scores
La moelle est « normalement riche » : Le frottis sanguin montre une plage d’hématies à peu près égale à celle recouverte par les cellules nucléées
Moelle de richesse augmentée ou très augmentée : Nappe de cellules nucléées entre lesquelles il n’y a pas de place pour les hématies
Moelle hypocellulaire : Peu d’éléments médullaires, hématies++++ (Eliminer d’abord la dilution du suc médullaire par le sang périphérique au moment de la ponction)
| 0 = Moelle désertique | très peu d’éléments observés et leur décompte reste inférieur à 100 |
| 1 = Moelle Pauvre | le décompte dépassera à peine 100 |
| 2 = Moelle Médiocre | intermédiaire entre moyen et pauvre |
| 3 = Moelle Moyenne | Intermédiaire entre pauvre et riche |
| 4 = Moelle Riche | persistance d’espaces libres entre les cellules |
| 5 = Moelle Très Riche | les cellules nuclées se touchent |
| Echec Désertique pauvre riche Très Riche | 0 +/- ++ +++ ++++ |
La richesse en mégacaryocytes
- Diminuée (+ ou 0)
- Normale (+++)
- Augmentée (++++)
Fort grossissement (x 100) : avec immersion
Etude qualitative du myélogramme
A. Reconnaissance des cellules médullaires : Différents stades de maturation
La lignée mégacaryocytaire :
Mégacaryoblaste
Mégacaryocyte basophile
Mégacaryocyte granuleux
Mégacaryocyte thrombocytogène ou plaquettogène
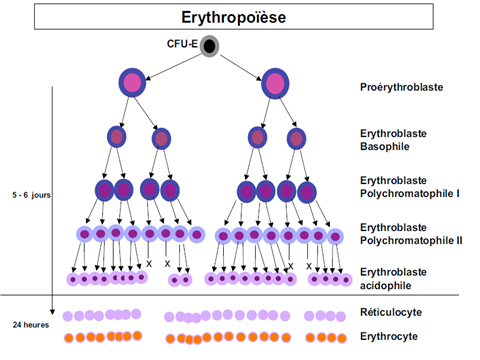
La lignée erythroblastique :
Proérythroblaste PE,
Erythroblastes basophile EB,
Erythroblastes polychromathophile EP
Erythroblastes acidophile EA
Parfois îlots érythroblastiques (macrophage central entouré d’une couronne d’érythroblastes)
La lignée granulocytaire :
Myéloblaste
Promyélocyte
Myélocyte neutrophile et éosinophile
Métamyélocyte neutrophile et éosinophile
Polynucléaires : neutrophile, éosinophile, basophile
Le reste du tissu hématopoïétique :
les lymphocytes
les plasmocytes
Les autres cellules : monocytes, mastocytes rares.
B. Les anomalies morphologiques:
Lignée mégacaryocytaire :
- anomalies nucléaires
- micromégacaryocytes…
Lignée erythroblastique :
- Gigantisme cellulaire, Asynchronisme de maturation nucléo-cytoplasmique
- Ponctuations basophiles, Corps de Joly
- Cytoplasme feuilleté, Ponts interchromatiniens, Condensation chromatinienne ….
Lignée granulocytaire :
- métamyélocytes géants
- dégranulation, présence de granulations toxiques
- hyposegmentation (pseudoPelger), hypersegmentation,
- appendices nucléaires, ….
Etude quantitative :
A. Décompte des cellules médullaires
Idéalement : Au moins 500 cellules.
En plusieurs zones de la lame
Si possible sur plusieurs lames
Rechercher l’excès de cellules hématopoïétiques immatures (blastes) ou matures (plasmocytes, lymphocytes…) et de cellules extrahématopoïétiques.
B. Valeurs de référence chez l’adulte
| Lignée Granuleuse Myéloblastes Promyélocytes Myélocytes neutrophiles Myélocytes éosinophiles Métamyélocytes neutrophiles Métamyélocytes éosinophiles Polynucléaires neutrophiles Polynucléaires Eosinophiles Polynucléaires basophiles Lignée erythroblastique Proérythroblastes Erythroblastes basophiles Erythroblastes polychromathophiles Erythroblastes acidophiles Autres cellules Lymphocytes Plasmocytes Monocytes | 60 à 70% 0 à 2% 1 à 4% 10 à 15% 0 à 1% 10 à 20% 0 à 1% 15 à 25% 0 à 1% 0 à 1% 15 à 30% 0 à 2% 1 à 3% 5 à 15% 5 à 10% 5 à 20% 0 à 3% 0 à 2% |
Le rapport érythroblastes/granuleux varie de 1/3 à 1/4
Mégacaryocytes : moins de 1% des cellules médullaires
c. Variations physiologiques
A la naissance:
moelle très riche.
Lignée erythroblastique :
Hyperplasie physiologique 30 à 45 %.
Erythroblastopénie (8 à 12%) au 8ème jour
Valeur de l’adulte : vers 2 à 3 mois
lymphocytes médullaires :
20 à 30 % dès le 7ème jour et jusqu’au 6ème mois.
Hématogones : précurseurs lymphocytaires B : à la naissance, nourrisson, jeune enfant il ne faut pas les confondre avec les blastes !!!
lymphoblastes (immunophénotypage : CD19+ CD10+ CD38+ CD22+HLADR+…)
Chez le jeune enfant : on trouve une grande quantité de lymphocytes.
D. Quelques anomalies quantitatives
Lignée érythroblastique :
Érythroblastose : érythroblastes supérieur à 30% : post-hémorragie ou post-hémolyse, carence vitamine B12/ folates, anémie sidéroblastique…
Érythroblastopénies : réticulocytes inférieur à 20 Giga/l, les érythroblastes < 5% des éléments nucléés médullaires dans une moelle riche : Parvovirus B19, thymome….
Lignée granuleuse :
Hyperplasie : les syndromes infectieux, syndromes myéloprolifératifs …
Disparition de la lignée neutrophile : agranulocytoses…
Lignée mégacaryocytaire :
Hypo ou amégacaryocytose : envahissements, post-radio et/ou chimiothérapie.
Hypermégacaryocytoses : thrombopénies périphériques, atteintes toxiques (surtout médicamenteuses) …..
5. Résultats : compte rendu
Dans le compte redu d’un médullograme il faut mentionner les points suivants:
la richesse médullaire.
la richesse en mégacaryocytes.
le décompte des différentes lignées.
commentaire qualitatif sur les différentes cellules observées, les anomalies constatées.
conclusion
Aussi, il ne faut pas oublier de mentionner La dilution.
6. Conclusion
Myélogramme est un moyen de diagnostic précieux
Sa réussite Impose :
la maitrise de toutes les étapes de sa réalisation du prélèvement à la lecture.
la reconnaissance des anomalies quantitatives et qualitatives.
la concertation de toute équipe afin de livrer un diagnostic sans équivoque.