INTRODUCTION :
L’équilibre acido-basique (EAB) est l’ensemble des mécanismes qui maintiennent à un niveau constant la concentration en ion H+ du milieu intérieur (exprimée en pH). Le pH du sang artériel d’un sujet normal est stable malgré l’agression acide continue, cette stabilité est indispensable au bon fonctionnement des protéines et à l’activité optimale des enzymes. D’ou’ l’importance vitale d’une régulation étroite du pH de l’organisme entre 7,35 et 7,45 qui va être assurée par les systèmes tampons et deux organes : le poumon et le rein.
I/ GENERALITES
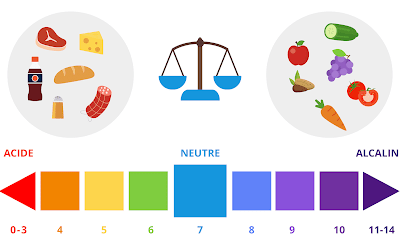
La concentration en ion H+ d’une solution correspond à son acidité, elle est appréciée par la mesure du pH : pH = log 1/ [H+]. L’EAB résulte d’un bilan équilibré entre les entrées et les sorties d’ion H+ :
1/ Origine des ions H+ : sont de deux types ;
– Alimentation : riches en protides (végétaux sont surtout alcalins)
– Métabolisme :
+ Acides volatils : CO2 assimilé à un acide faible, produit par le métabolisme et éliminé par le poumon selon un équilibre nécessitant l’anydrase carbonique (AC) :
+ Acidesfixes: de concentration bien moins que CO2 mais très agressifs car ils sont fortement dissociés, ils peuvent être organiques dont l’anion métabolisable (ac.lactique, corps cétoniques) ou minéraux difficilement métabolises (ac.phosphorique, ac.sulfurique)
2/ Elimination des ions H+ : elle est assurée par deux voies :
-Le CO2 éliminé par le poumon (sortie rapide et massive d’ac.carbonique)
-L’élimination rénale des ac.fixes par réabsorption des bicarbonates en échange avec H+ et élimination des ion H+ liés aux acides fixes.
3/ Régulation de l’équilibre acido-basique :
Elle fait intervenir deux mécanismes :
-Le premier correspond à la mise en jeu des systèmes tampons.
-Lerelais est pris par l’intermédiaire de moyens physiques représentés par le poumon et le rein ensuite.
*Les systèmes tampons sont des substances qui tendent à minimiser les variations de la concentration des ions H+ (pH,), c’est un acide ou une base faible non dissocié en équilibre avec sa forme dissociée. Leur réaction est immédiate.Le système tampon des hydrogénocarbamates formé par H2CO3et HCO3- est le plus efficace du fait de sa bonne concentration plasmatique : 22 à 26 mmol/l, son pK proche du pH de l’organisme et de son caractère ouvert grâce la régulation de la ventilation (l’élimination de l’ac.carbonique par le poumon par le maintient du PCO2 constante) :
CO2 + H2O↔H2CO3↔ H+ + HCO3-
Ce tampon est soumis à un double contrôle par deux systèmes régulateurs : le poumon et le rein .Le pH est donc selon l’Equation d’ Henderson Hasselbach :
PH = 6,1 + log [HCO3-]/aPCO2 = Rein/Poumon
Ce tampon va agir immédiatement comme première ligne de défense, évitant une baisse rapide du pH mais son efficacité est limitée dans le temps car le sel tampon va être consommé. Il y a d’autres tampons d’importance non négligeable comme les protéines sanguines, les phosphates sodiques et le système des hémoglobines au niveau des GR sans oublier les tampons intracellulaires de mécanisme encore mal connu.
*Les moyens physiques qui vont prendre le relais sont :
–Poumon : son intervention est rapide par le contrôle respiratoire de la PCO2, les centres respiratoires bulbaires sont très sensibles aux variations du PH, toute diminution du PH va entraîner une hyper ventilation qui augmente l’élimination du CO2 et donc une diminution de la concentration des ions H+ selon: CO2 + H2O↔ H2CO3 ↔ H+ + HCO3-
Cette régulation reste limitée sur le plan anatomique, biochimique et physiologique et n’agit que sur la composante acide du système bicarbonate /acide carbonique.
–Rein : son action est tardive mais plus efficace et durable et agit aussi bien contre l’acidose que contre l’alcalose.Le rôle du rein dans l’ EAB est double :
· Réabsorption des bicarbonates filtrés dans le tube proximale.
· Elimination des ions H+ au niveau du tube contourné distale en échange avec un ion Na+, à ce niveau il y a une compétition entre H+ et K+ (du même au niveau cellulaire), ce qui explique qu’une acidose sera génératrice d’hyperkaliémie etréciproquement.Les ions H+ sont sécrétés pour les 2/3 sous forme de NH4+ et le 1/3 sous forme phosphate diacide (acidité titrable), ce dernier est le tampon le plus important.
III/ EXPLORATION BIOCHIMIQUE :
Le bilan de base appelé GAZOMETRIE comprend : PH, PCO2 et calcul de concentration du HCO3-, les paramètres d’oxygénation : PO2, Sa O2 .Un bilan complémentaire sera aussi demandé et comprend : l’Ionogramme sanguin (Na+, K+, CL-), mesure du Trou anionique, dosage des lactates sanguin et corps cétoniques urinaires
C’est une exploration demandée le plus souvent dans le cadre de la réanimation, elle constitue une urgence technique :
1/ Prélèvement :
Il se fait sur sang artériel par ponction directe au niveau d’une artere (fémorale, radiale), et pour le nouveau né par prélèvement capillaire (pulpe de doigt).
On utilise une seringue à usage unique heparinée,la ponction et la conservation doivent être réalisées à l’abri de l’air(seringue hermétiquement fermée) : anaérobiose stricte( 1h max,sans choc,sans variation thermique)homogénéiser délicatement le sang avant la mesure(20à30s)tenir compte de la T°du malade ,de l’état de ventilation et de la pression atmosphérique. L’acheminent au laboratoire doit être rapide et le transport dans la glace.
2/ Mesure du PH sur sang total :
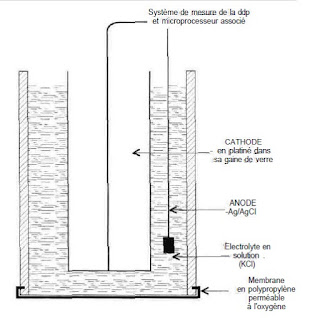
Se fait par méthode potentiométrique qui consiste en une détermination d’une différence de potentiel (Ddp) entre une électrode de mesure en verre thermo statée à 37° et une électrode de référence (électrode en platine plongée dans une solution d’ HCLO,1 M ( FIG 1 ).L’électrode de mesure est introduite dans la solution à mesurer ce qui donne de part et d’autre de la membrane de verre une Ddp proportionnelle à la concentration en protons .(selon l’équation de Nernst :PH = E / K.P ,
E= Ddp, k : constante, P : pente de l’électrode.). Il est nécessaire de corriger les résultats rendus en fonction de la T° du malade (pH à T° du patient = pH à 37 ° -a (T- 37) ; a = 0,014).
FIG 1 : Électrode de verre pour la mesure du pH associée à une électrode de référence.
3/ Mesure de la PCO2 :
Se fait grâce à l’électrode de Severinghaus miniaturisée thermo statée (FIG. 2), le CO2 du spécimen à mesurer diffuse à travers une membrane de téflon et fait varier le pH de la solution de bicarbonate, l’électrode de verre détecte cette variation, qui est proportionnelle à la concentration de CO2 de l’échantillon à mesurer.
Valeurs physiologiques : 35 à 44 mm Hg au sang artériel (4,65 à 5,8 Kpa)
FIG 2 : Electrode de Severinghaus
4/ Mesure de la pression partielle en O2 :
Se fait par Ampérométrie utilisant l’électrode de Clark ( FIG. 3 ) , le principe est basé sur sur le fait qu’ une électrode soumise à un potentiel constant fournit un courant directement proportionnel à la PO2 . L ‘O2 diffusant à travers une membrane de polypropyléne subit une réduction au niveau de la cathode, le débit d’électrons consommés est proportionnel à PO2 (cette pression est en rapport avec O2 dissous et non pas celui combiné à l’hémoglobine). Enfin la PO2 est sensible à la température (si le prélèvement est conservé à 4° il doit être réchauffe à T° ambiante avant dosage) de même il faut tenir compte de la pression atmosphérique.
Valeurs physiologique : 70 à 95 mm Hg (sang artériel)
FIG .3 Electrode de Clark.
5/ Autres paramètres :
*Taux de saturation de l’hémoglobine (Hb) en O2 : calculé par un microprocesseur inclus dans l’automate d’analyse ;il est de 96٪ à 98٪ dans le sang artériel d’un adulte sain.
*Détermination des hydrogénocarbonate : calculée à partir du PH et de PCO2 grâce à l’équation d’ Henderson Hasselbach : PH = PKa + log ( [HCO3-] / a PCO2 ) ; a :coefficient de solubilité de CO2 ;
Elle peut être aussi mesurée par méthode enzymatique (très utilisée sur les automates multiparamétriques) :
HCO3- + Phosphoénolpyruvate ↔ oxaloacétate + NADH, H+ ↔ malate + NAD+ (Diminution de l’absorbance à 340 nm)
Les valeurs normales : 22 à 26 mmHg.
*Autres paramètres biochimiques :
ü l’ ionogramme sanguin par électrode sélective et mesure par potentiomètre directe ou directe ( Kaliémie , Chlorémie ) avec calcul du trou anionique : Mise en évidence de la présence d’anions indosés :TA = ( Na+ + k+) _ (HCO3- + CL – ), normalement vari de : 12 à 16 meq / l .
ü Détermination des lactates (méthode enzymatique) :.valeur normale : 1-2 mmol/l.
ü Dosage des corps cétoniques (recherche urinaire à la bandelette).
IV – DES EQUILIBRES ACIDO-BASIQUES :
La connaissance de l’équation d’ Henderson Hasselbach permet de voir que le PH est directement lié à la valeur : [HCO3-] / a PCO2.
PH= 6,1 + log [HCO3-] / a PCO2
Les bicarbonates du numérateur sont d’origine métabolique et sont liés à la fonction rénale.La PCO2 du dénominateur est d’origine respiratoire et sont liés à la fonction pulmonaire.Donc si le trouble initiale provient d’une variation de HCO3- ; il est dit métabolique et si le trouble initiale provient de la PCO2 ; il est dit respiratoire.
La compensation en cas de perturbation a pour but de ramener [HCO3-] / a PCO2 à sa valeur normale et le PH à sa valeur de référence , on parle de trouble compensé. Si le PH reste en dehors des valeurs de référence malgré les tentatives de compensations il s’agit d’une perturbation décompensée.
Il y a différents tableaux cliniques qu’on peut regrouper dans quatre troubles :
1/ Acidose métabolique : le PH < 7 ,35 et diminution des bicarbonates < 22 mmol / l.
La compensation se fera par diminution de la PCO2 par hyperventillaton, il faut systématiquement calculer le trou anionique (TA) lors de la recherche étiologique :
*Acidose métabolique à TA normal : il y a perte d’HCO3- remplacée par le chlore (toujours hyperchlorémique), ceci peut se rencontrer dans les pertes digestive d’HCO3-, dans les pertes rénales par défaut de réabsorption d’HCO3- ou de sécrétion d’ H+.
*Acidose métabolique à TA augmenté :il y a des acides fixes supplémentaires, la Chlorémie est normale ,ceci peut se voir en cas de surcharge acide exogène ( intoxication aux salicylés …),surcharge acide endogène ( acidocétose diabétique, acidose lactique ) ou de baisse des pertes rénales d’ H+ ( insuffisance rénale ).
2/ Acidose respiratoire : PH < 7 ,35 avec PCO2 > 45 mmHg, la [HCO3-] normale
La PO2 est abaissée par hypoventilation alvéolaire observée dans les insuffisance respiratoire (d’origine pariétale , parenchymateuse ou diverses ) ,il y a une hyperkaliémie modéré fréquente et la compensation se fait par élévation des bicarbonates plasmatique.
3/ Alcalose métabolique :PH > 7 ,45 avec augmentation des bicarbonates > 28 mmol/l.
La compensation se fait par augmentation de la PCO2 par hypoventilation. Les étiologies
Elles peuvent être une perte d’H+ (digestive ou rénale ) ou des surcharges en bases (exogène ou endogène) .
4/ Alcalose respiratoire : PH > 7 ,45 avec hypocapnie :PCO2 < 35 mmHg et [ HCO3-] normal.
La compensation se fait par diminution des bicarbonates par diminution de la réabsorption rénale. Les étiologies sont multiples : hyperventilation par affection cérébrale, hypoxie d’altitude ou stress, hyperthermie maligne, baisse d’Hb ….
CONCLUSION
L’équilibre acido-basique est l’ensemble des mécanismes qui maintiennent à un niveau constant la concentration en ion H+ du milieu intérieur.
La mesure des paramètres de l’EAB se pratique dans un contexte médical particulier : Bilan de réanimation indispensable. L’exploration acido-basique : Gazométrie est une Urgence technique avec prélèvement sanguin artériel anaérobie.
Les troubles acido-basiques sont majeurs et nécessitent un suivi biologique des malades afin d’assurer une correction thérapeutique rapide. Les appareils actuels mesurent les gaz du sang, l’ionogramme et le taux d’Hb, donnant ainsi le maximum de renseignement.