GENERALITES
Il s’agit du processus de coagulation du plasma sanguin aboutissant à la transformation du fibrinogène plasmatique circulant soluble en fibrine insoluble enserrant le clou plaquettaire par le biais d’une série de réactions enzymatiques dont le contrôle continu permet une restriction locale sans diffusion à distance de la zone lésionnelle.
Le processus central de la coagulation est la génération de la molécule de thrombine, enzyme clé de la coagulation, permettant la transformation du fibrinogène en fibrine et assurant la rétroactivation et l’amplification des différentes étapes tant de la coagulation que de l’hémostase primaire.
LES PARTICIPANTS
1. Eléments cellulaires :
§ Les cellules endothéliales et les monocytes
§ Les plaquettes activées
§ Les monocytes
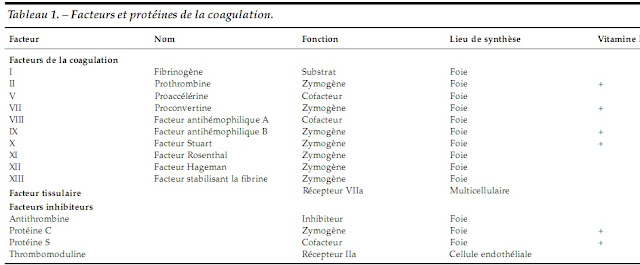
2. Facteurs de coagulation :
§ Ce sont des protéines plasmatiques reparties en deux groupes principaux :
ü Les protéines à activité enzymatique.
ü Les protéines dénuées d’activité enzymatique mais servant de cofacteurs
§ Elles sont au nombre de 12 et bien qu’elles aient chacune un nom usuel, un numéro en chiffre romain leur a été attribué selon la nomenclature internationale.
§ Les facteurs de la coagulation sont synthétisés au niveau du foie par l’hépatocyte, et toute insuffisance hépatocellulaire sévère entraîne une diminution globale des facteurs de la coagulation par défaut de production.
a. Précurseurs enzymatiques
§ Les facteurs vitamine K-dépendants II, VII, IX, X d’une part, et les facteurs contacts XI, XII, prékallicréine d’autre part, circulent dans le plasma sous la forme d’un précurseur enzymatique inactif. Ils possèdent un site actif protéolytique au niveau de la région C terminale, qui est masqué tant que la molécule n’est pas activée.
§ L’activation consiste en une hydrolyse partielle de la molécule démasquant le site sérine-protéase. Le facteur activé a ainsi la capacité d’activer par hydrolyse un autre facteur dans une véritable cascade enzymatique.
§ La vitamine K est nécessaire à l’acquisition des propriétés fonctionnelles des facteurs II, VII, IX et X.
§ Les facteurs contacts (facteurs XI, XII, prékallicréine), dont la synthèse ne dépend pas de la vitamine K, sont activés par le contact avec une surface non mouillable (verre du tube par exemple), ou chargée négativement (sous-endothélium).
b. Le fibrinogène
§ Est un polypeptide synthétisé par l’hépatocyte et son taux plasmatique est de l’ordre de 2 à 4 g/l, taux accru lors des états infectieux ou inflammatoires ou bien diminué par consommation excessive dans certains états pathologiques [CIVD].
§ L’effet hydrolytique de la thrombine permet la polymérisation des chaînes de fibrinogène en gel de fibrine.
§ Le facteur XIII, ou facteur de stabilisation de la fibrine, renforce la cohésion des molécules de fibrine par la création de liaisons covalentes intermoléculaires, rendant le réseau de fibrine plus stable et plus solide.
c. Les Cofacteurs : facteurs V et VIII
§ Les facteurs V et VIII sont dépourvus d’activité enzymatique mais accélèrent les réactions entre une enzyme et son substrat, d’où leur nom de cofacteurs.
§ Ils sont activés par la thrombine (Va et VIIIa) qui réalise une hydrolyse partielle des molécules.
§ Les facteurs Va et VIIIa ont donc un rôle de potentialisateur des interactions enzymatiques et interviennent respectivement au sein de deux complexes enzymatiques de la cascade de la coagulation, le complexe tenase (VIIIa) et le complexe prothrombinase (Va).
§ Ces facteurs ne sont pas vitamine-K dépendants et sont synthétisés dans l’hépatocyte.
§ Le facteur VIII, ou facteur antihémophilique A, circule dans le plasma associé au VWF qui joue ainsi le rôle de protéine transporteuse.
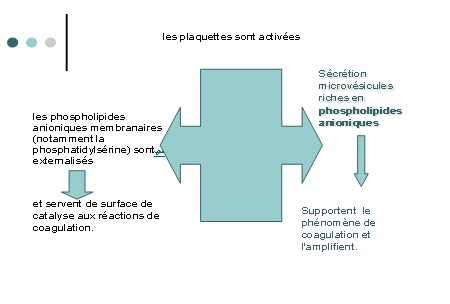
3. Phospholipides activateurs de la coagulation
§ Ils constituent une surface moléculaire catalytique permettant le déclenchement de la coagulation et sont exposés lors de conditions pathologiques ou réactionnelles.
§ La fixation aux phospholipides membranaires de l’enzyme protéolytique, de son substrat et du cofacteur catalytique accélère grandement leurs interactions.
§ Les phospholipides impliqués dans le déclenchement de la coagulation comprennent:
ü La phosphatidylsérine plaquettaire(F3P) : exprimée à la surface de la membrane plaquettaire lors de son activation
ü Le facteur tissulaire, protéine transmembranaire, est exprimé par les cellules sous-endothéliales, fibroblastes et cellules musculaires lisses, il est exposé aux protéines procoagulantes lors d’une brèche vasculaire, avec mise à nu des structures sous-endothéliales.
§ Le facteur tissulaire est le récepteur du facteur VII activé et leur liaison déclenche le processus de cascade enzymatique de la coagulation.
4. Inhibiteurs de la coagulation
§ Trois groupes d’inhibiteurs selon leur structure et fonction :
ü Système de la protéine C activée régule la coagulation par protéolyse et fait intervenir :
Ø Deux protéines plasmatiques vit K dépendantes, la protéine C (zymogène d’une serine protéase) et son cofacteur, la protéine S.
Ø Un récepteur membranaire : thrombomoduline
ü Inhibiteurs de serine protéases ou serpines : Antithrombine+++ (AT), Cofacteur II de l’héparine (HCII), α1-antitrypsine et C1-inhibiteur.
ü TFPI (Tissue Factor Pathway Inhibitor) appartient aux inhibiteurs type Kunitz.
LES ETAPES DE LA COAGULATION
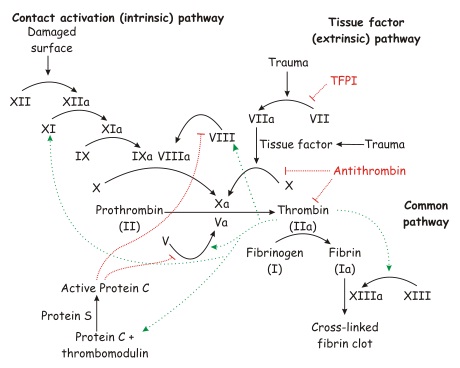
1. Initiation de la coagulation :
a. Par le facteur tissulaire :
§ Lors d’une lésion vasculaire, le FT présent dans l’adventice fixe à la fois le F. VII et les traces de F. Vlla du sang circulant, avec autoactivation immédiate du F. VIl . Le complexe binaire FT/Vlla active ensuite simultanément les F. IX et X fixés sur les surfaces membranaires, initiant ainsi la voie exogène de la coagulation
b. Par le système contact :
§ Exposition du collagène sous endothélial capable d’activer le système contact (prékallicréine, FXII, KHPM et FXI) aboutissant à l’activation du FXI.
§ FXIa active le FIX en présence des PLP initiant la voie intrinsèque de la coagulation.
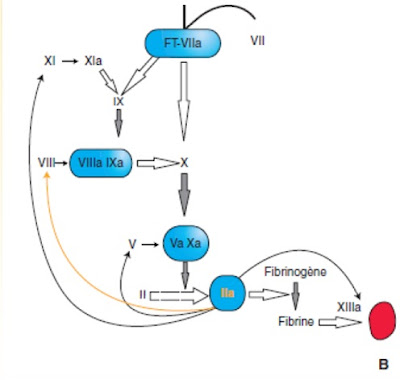
2. La formation de thrombine
a. Voie tissulaire :
§ Complexe FVIIa/FT/PLP/Ca²+ active par protéolyse FIX en FIXa ou FX en FXa:
ü FIXa forme le complexe tenase avec FVIIIa (cofacteur) en présence de PLP et Ca²+. Ce complexe active le FX en FXa.
ü FXa forme le complexe prothrombinase avec le FVa (cofacteur) en présence de Ca²+ et PLP. Ce complexe active le FII en thrombine.
b. Voie endogène :
§ Prékallicréine est transformée en kallicréine par une protéase de la paroi vasculaire. La kallicréine active le FXII qui active le FXI.
§ FXIa active par protéolyse le FIX avec formation du FIXa qui forme le complexe tenase et etc…
§ La thrombine formée amplifie sa propre formation par recrutement de nouvelles plaquettes, activation des cofacteurs VIII et V et activation du FXI.
3. La fibrinoformation
§ Au seuil critique, la thrombine convertit le fibrinogène en fibrine qui forme un réseau autour de l’agrégat de plaquettes. Le caillot est stabilisé par FXIIIa.
§ L’activation du FXIII est réalisée par la thrombine.
§ FXIIIa est une transglutaminase qui stabilise le caillot en créant des liaisons covalentes entre les polymères de fibrine.
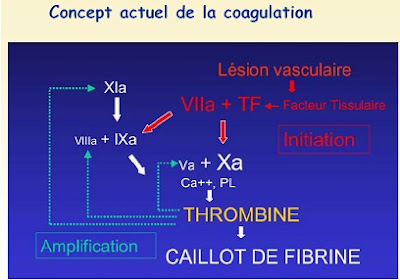
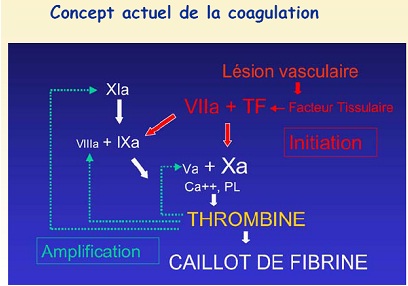
p Concept actuel de la coagulation :
Etapes de la coagulation :
ü Initiation de la coagulation
§ La coagulation est initiée par le complexe FTFVIIa.
§ FVIIa est le seul facteur existant à l’état de traces dans le plasma.
§ La liaison du FVIIa au FT entraîne une modification conformationnelle du FVII, générant encore du facteur VII activé.
§ Le complexe [FT-FVIIa] peut activer le FIX et le FX.
§ L’activation directe du FX est faible car elle est limitée par un inhibiteur appelé tissue factor pathway inhibitor (TFPI).
§ L’activation du FX par le FIXa est faible aussi car elle nécessite la présence d’un cofacteur non présent à cette phase : le FVIIIa.
§ Cette phase d’initiation ne génère donc que des traces de thrombine.
§ La quantité de thrombine générée ne suffit pas pour produire la fibrine nécessaire à la constitution du caillot, mais permet le déclenchement de la phase de propagation de la coagulation.
ü Amplification de la coagulation
§ La thrombine générée clive le FVIII et forme l’hétérotrimère FVIIIa.
§ Après que la thrombine, et à un moindre degré le FXa, ont activé le FVIII, celui-ci se sépare du vWF pour se lier aux phospholipides plaquettaires sur lesquels il est concentré.
§ C’est donc à la surface des plaquettes que se produit la phase d’amplification : le FIXa généré pendant la phase d’initiation est fixé de façon diffuse sur les plaquettes, où il se lie au FVIIIa en présence de calcium.
§ Le complexe ainsi créé [IXa-VIIIa] s’appelle aussi tenase ou tenase intrinsèque.
§ Dans ce complexe, le FVIIIa augmente la catalyse du FX par le FIXa d’un facteur supérieur à 105, induisant la présence de FXa en forte concentration.
§ De plus, la thrombine active le FV en FVa qui se fixe lui aussi à la surface des plaquettes.
§ Le complexe [FXa-FVa] s’appelle aussi complexe prothrombinase.
À la fin de la phase d’amplification se trouvent donc à la surface des plaquettes activées des facteurs de coagulation activés en concentration importante.
ü Propagation de la coagulation :
§ À la surface des plaquettes, le complexe tenase génère des quantités importantes de FXa.
§ L’activation du FX en FXa par le complexe tenase est 50 fois supérieure à celle du FX par le complexe [FT-FVIIa].
§ Le complexe prothrombinase clive la prothrombine en thrombine, mais après la phase d’amplification, la présence à la surface des plaquettes de concentrations élevées de facteurs activés permet la génération explosive de quantités importantes de thrombine (thrombin burst).
§ La thrombine générée aura de multiples effets :
§ Activation en boucle du facteur XI (FXI), du FVIII et du FV,
§ Activation des plaquettes et surtout protéolyse du fibrinogène en monomères de fibrine. La polymérisation spontanée de ces monomères crée la trame du réseau de fibrine qui structure le caillot.
§ Ce caillot est consolidé par l’action du FXIII, lui-même activé par la thrombine
En résumé :
ü La phase d’initiation, conduit à la génération de faibles traces de thrombine à la surface de cellules exprimant du facteur tissulaire (FT).
ü La phase d’amplification, aboutit à l’accumulation de facteurs activés à la surface des plaquettes.
ü La phase de propagation comporte l’assemblage de larges complexes enzymatiques à la surface des plaquettes, la génération explosive de fortes concentrations de thrombine induisant la formation caillot stable.
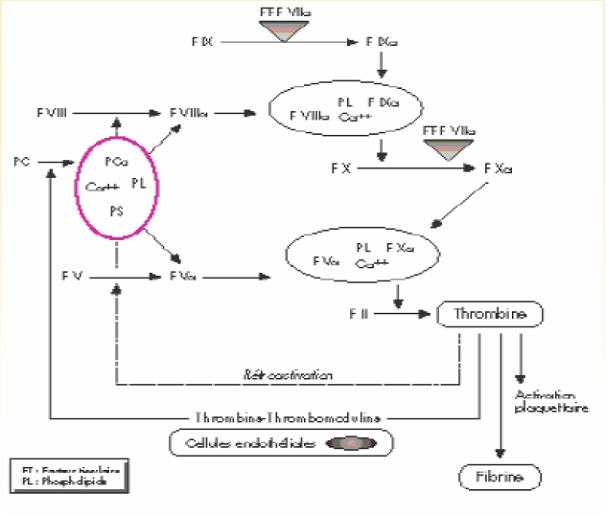
ü Régulation de la coagulation : Extension de la coagulation est prévenue par :
Ø le flux sanguin
Ø les propriétés antithrombotiques de la cellule endothéliale.
Mécanismes :
ü Sulfates d’héparane de l’endothélium forment un complexe avec AT plasmatique. Ce complexe inhibe les facteurs activés de la coagulation, surtout la thrombine.
ü Thrombine se lie au récepteur PAR endothélial et induit la production de NO et prostacycline.
ü Thrombine se fixe à la thrombomoduline et active la protéine C plasmatique. La protéine C activée (en présence de la protéine S, PLP et Ca2+) clive les FVa et FVIIIa qui perdent leurs fonctions cofacteurs.
ü Complexe Xa-TFPI-Vlla-FT bloque l’activité du FT. (si FT libéré est en faible quantité).
RÉGULATION DE LA COAGULATION
§ Permet de limiter l’extension locale du caillot et d’éviter la diffusion à distance de la fibrinoformation.
§ L’antithrombine ( la vitamine K) est l’un des principaux inhibiteurs physiologiques de la coagulation. Elle neutralise préférentiellement l’activité de la thrombine (IIa) mais aussi celle des autres facteurs de la coagulation (VIIa, IXa, Xa).
§ Le système protéine C-protéine S est de découverte plus récente. Il s’agit de deux protéines synthétisées par le foie sous la dépendance de la vitamine K.
§ La protéine C+ thrombomoduline (membrane endothéliale) est activée par la thrombine. La protéine C activée (PCa) en présence de protéine S neutralise les cofacteurs Va et VIIIa, ralentissant par là considérablement la vitesse de génération de la thrombine. Leurs deficits entrainent un risque accru de thrombose veineuse.
Inhibiteurs de la coagulation
|
Nom
|
Fonction
|
|
Antithrombine
|
§ Inhibe IIa, Xa
|
|
Protéine C
|
§ Inactive Va et VIIIa
|
|
Protéine S
|
§ Cofacteur de protéine C
|
|
Tissue factor pathway inhibitor (TFPI)
|
§ Inhibe le complexe Facteur tissulaire
§ Facteur VIIa et Xa
|
|
Inhibiteur dépendant de la protéine Z (ZPI)
|
§ Inhibe X et XI.
|
|
Protéine Z
|
§ Cofacteur de ZPI
|
|
Heparin cofactor II
|
§ Inhibe IIa
|
EXPLORATION DE LA COAGULATION
§ Nécessaire pour apprécier un risque hémorragique ou thrombotique.
§ Fait appel à un examen clinique et interrogatoire afin de rechercher :
ü Antécédents hémorragiques ou thrombotiques personnels et familiaux.
ü Pathologies associées et histoire des hémorragies ou thromboses (fréquence, intensité, territoire,…).
ü Hémorragies :
– Hématomes de localisation musculaire ou profonde.
– Hémarthroses.
– Retardées après trauma ou chirurgie, volontiers récidivantes.
ü Thrombophilies constitutionnelles ou acquises.
1. Etape pré-analytique
§ Prélèvement veineux, acheminé au laboratoire sans délai:
ü Garrot peu serré, posé depuis moins d’une minute. Le premier tube prélevé ne doit pas être celui de l’hémostase (activation de l’hémostase quand la veine est traversé par l’aiguille).
ü Anticoagulant : citrate trisodique 0,109 M (3,2 %), 1V citrate/9V sang. Si hématocrite <30 ou= » »>55%, volume d’anticoagulant doit être ajusté.
ü Centrifugation à 2500/3000g pendant 15 min afin d’obtenir un plasma pauvre en plaquettes :
ü Il sera utile de réaliser une deuxième centrifugation pour certains tests.
ü Echantillon analysé dans les 2 heures, sinon congélation à -80°C.
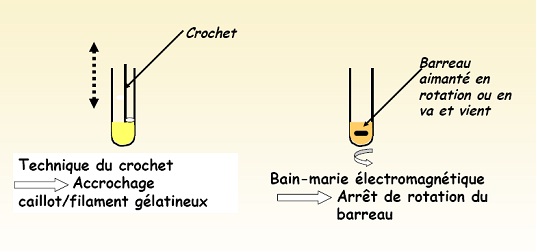
2. Détection mécanique de la formation du caillot de fibrine :
3. Tests de première intention
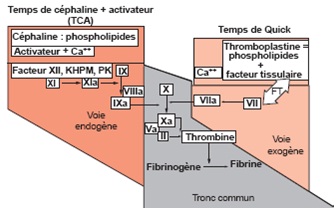
§ Voie endogène et tronc commun sont explorés par TCA.
§ Voie exogène et tronc commun sont explorés par Temps de Quick.
a. Temps de Quick
§ Principe : Temps de coagulation à 37°C d’un plasma pauvre en plaquette (PPP) recalcifié en présence d’un excès de thromboplastine.
§ Indications :
ü Bilan préopératoire,
ü Rechercher un désordre de la voie exogène,
ü Evaluation du degré d’insuffisance hépato-cellulaire,
ü Surveiller un traitement anticoagulant oral.
§ Mode opératoire : Incubation à 37°C du PPP (1V) et de thromboplastine calcique (2V). Constater l’apparition du caillot de fibrine.
§ Expression des résultats en:
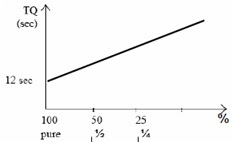
ü Seconde par rapport au temps témoin (10-14sec)
ü Taux de Prothrombine (TP) exprimé en %. VN: 70-100%. Cette conversion se fait grâce à une droite de Thivolle :
ü INR = [TQ patient/TQ témoin] ISI Utilisé pour la surveillance du traitement AVK afin de réduire les variations liées aux différentes thromboplastines.
INR : International Normalized Ratio, ISI : International Index Sensibility.
b. Temps de céphaline et activateur (TCA) ou APTT
§ Principe : Temps de coagulation à 37°C d’un PPP recalcifié en présence de céphaline et activateur de la phase contact (Kaolin, acide ellagique).
§ Indications :
ü Bilan préopératoire.
ü Rechercher un désordre de la voie intrinsèque ou Ac circulant.
ü Surveiller un traitement par héparine non fractionnée.
§ Mode opératoire : Incubation à 37°C du PPP (1V) et du mélange céphaline / activateur (1V) pd 2-5 mn selon les réactifs. Ajout du CaCl2 (0.025 M, 1V). Constater l’apparition du caillot de fibrine.
§ Expression des résultats : TCA du patient comparé au TCA témoin. Valeurs normales selon réactif et âge du patient : Ratio TCA patient /TCA témoin R < 1,2
c. Dosage fonctionnel du fibrinogène
§ Méthode chronométrique de Von Glauss : mesure le temps de coagulation à 37°C d’un PPP du patient dilué en présence de Ca2+ et d’un excès de thrombine.
§ Droite de calibration réalisée à l’aide d’un plasma titré en fibrinogène.
§ VN: 2-4g/l.
4. Tests de seconde intention
a. Dosage de l’activité des facteurs de coagulation
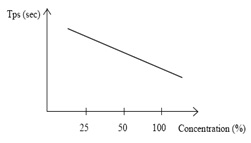
§ Droite de calibration.
§ Mélange V / V du PPP du patient dilué au 1/10 ou au 1/20 et du plasma témoin déplété en facteur à doser.
§ Réalisation du TQ pour les dosages des facteurs II, VII, V, X ou du TCA pour les dosages des facteurs VIII, IX, XI, XII.
§ Déduire la concentration du facteur sur la droite de calibration.
→Déficit ou taux élevé en facteur de la coagulation.
b. Activité du FXIII
§ N’est pas explorée par les tests de première intention.
§ Devant un syndrome hémorragique inexpliqué, estimation de l’activité du XIII par rédissolution du caillot de fibrine par l’acide monochloracétique.
c. Etude des systèmes inhibiteurs de coagulation
§ Recherche de la résistance à la protéine Ca (APCR).
§ Dosage de l’activité de l’AT.
§ Dosage de l’activité de la PC.
§ Dosage de l’activité de la PS.
5. Recherche ACC (anticoagulants circulants):
§ Rechercher si TCA allongé
ü Test de correction:
Ø Mélanger volume à volume plasma témoin + plasma malade
Ø Incubation 2H à 37°
Ø Puis mesurer TCA malade, témoin et mélange
Ø  Calcul indice de Rosner: TCA mélange – TCA témoin x 100
Calcul indice de Rosner: TCA mélange – TCA témoin x 100
TCA malade
Ø > 15%: ACC+ = présence d’anticorps circulant
Ø 12-15%: Douteux
Ø < 12 % recherche négative
Ø < 12 % recherche négative
ü Rechercher et titrer l’anticorps.
6. Techniques d’exploration de la coagulation
a. Chronometrique
§ Mesure vitesse formation caillot après ajout réactifs déclenchants appropriés.
§ Systèmes détection caillot:
§ Manuelle: visuelle
§ Electromagnétique: changement position bille
§ Optique: ¯ intensité lumière transmise
§ Coût ¯
§ Mesure activité catalytique seule.
b. Colorimetrique
§ Evaluation activité enzymatique /substrat chromogène synthétique après clivage de l’enzyme (405nm)
§ Dosage spécifique facteurs et inhibiteurs
§ Reproductible
§ Automatisable
§ Coût
§ Mesure activité globale
CONCLUSION
§ Coagulation temps essentiel hémostase.
§ Déroulement normal Ü intégrité tous les composants de l’hémostase.
§ Interprétation bilan d’hémostase:
ü Renseignements cliniques
ü Bilan biologique complet
Þ Rôle du biologiste : démarche diagnostique / anomalie bilan hémostase.
Le site www.avo6.com propose un contenu éditorial pour préserver au mieux sa santé. Des conseils et astuces qui vous accompagneront dans votre quotidien autour de la nutrition, les médicaments, beauté, les analyses médicales, le bien-être et les actualités médicales.