DEFINITION
Electrophorèse: terme d’origine grecque signifiant transport ou anciennement cataphorèse.
L’électrophorèse est un processus de migration des molécules chargées (phase solide), dans un milieu liquide tamponné, sous l’influence d’un courant électrique continu.
Elle permet de séparer, de doser et d’identifier les constituants d’un mélange en solution en se fondant sur la différence de migration de ses composants, lorsqu’ils sont soumis à un champ électrique.
Après migration, les différentes protéines se localisent au niveau d’une zone donnée du support d’où le nom électrophorèse de zone.
PRINCIPE
L’électrophorèse regroupe les méthodes de séparation reposant sur les différences de vitesse de migration des protéines chargées dans une solution d’électrolytes sous l’influence d’un champ électrique sur un support donné.
Les molécules chargées (-) anions: migrent vers l’anode (+)
Les molécules chargées (+) cations: migrent vers la cathode (-)
Les protéines sont séparées en fractions de mobilité différente,
Les techniques de révélation sont nombreuses pour quantifier ces protéines
ETUDE THEORIQUE DU DEPLACEMENT ELECTROPHORETIQUE
1. Origine des charges
Les substances ayant des groupes fonctionnels capables de s’ioniser en solution donnent naissance à des particules chargées positivement ou négativement.
Cette ionisation dépend non seulement de la nature même des composés, mais également du milieu environnant qui intervient par sa composition, son pH et sa force ionique.
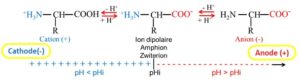
On définit le point isoélectrique (pHi) comme la valeur du pH pour lequel il n’y a aucune migration électrophorétique (l’ensemble des charges est nul).
®Seule la charge nette Q d’une particule intervient dans son déplacement (mobilité électrophorétique).
La charge nette Q est variable selon le pH de la solution dans laquelle elle est diluée,
ü Si pH > pHi, la protéine a une charge globale négative; dans un champ électrique, elle se déplace vers l’électrode + (anode)
ü Si pH < pHi, la protéine a une charge globale positive; dans un champ électrique, elle se déplace vers l’électrode – (cathode)
ü Si pH = pHi, la protéine est sous forme d’un zwitterion (neutre); elle ne se déplace pas sous l’influence d’un champ électrique
2. Mobilité électrophorétique : µ
Chaque particule a une µ spécifique.
Si 2 électrodes sont reliées à un générateur de courant continu et qu’une certaine tension est imposée, il se crée entre ces 2 électrodes un champ électrique E capable d’exercer une certaine force F sur un granule que l’on suppose sphérique de rayon r (ionisée à charge nette Q).
Cette force provoque la migration de la particule ionisée vers l’électrode de charge opposée avec une certaine vitesse V.
F=E x Q
Par opposition à cette force F, il y a F’ : force de frottement due à la viscosité du milieu (éta) η et elle va s’opposer à la migration de la particule et la freiner.
F’=6 η r π v
V : vitesse de la particule exprime en cm/seconde
Mobilité électrophorétique µ
Formule: u = v / E= Q/6 η r π
Chaque espèce de molécules ayant des mobilités différentes, il est possible en se basant sur cette propriété d’effectuer leur séparation.
3. Le support
Quelle que soit sa nature, le support possède un pouvoir adsorbant capable de ralentir les migrations.
Il faut noter que les sinuosités dans les canalicules du support font apparaître une distance parcourue plus petite que la distance réellement parcourue → étalement des bande de séparation.
4. Le champ électrique
Le déplacement électrophorétique est proportionnel :
ü à la mobilité de la particule considérée,
ü au champ électrique E
ü au temps pendant lequel ce champ est imposé.
La mobilité étant une caractéristique de la particule considérée, donc pour obtenir une meilleure séparation, il faudra agir sur le champ électrique et le temps.
5. La force ionique : Fi
Elle intervient sur la valeur du champ électrique et sur la mobilité des composés.
6. Le pH
L’action du pH est prépondérante pour les composés organiques ayant des groupements acides faibles ou bases faibles,
Ainsi que pour les composés amphotères, il est stabilisé en utilisant des solutions tampons.
DÉPLACEMENTS DUS A DES PHÉNOMÈNES SECONDAIRES
1. Le mouvement d’électroendosmose
Le liquide contigu aux molécules en déplacement est chargé en sens contraire.
Il se déplace donc dans le sens opposé au courant électrique.
Le mouvement d’électroendosmose intéresse l’ensemble de la solution d’électrolytes, imprégnant le support, qui se déplace toute entière vers le pôle négatif.
L’amplitude du déplacement dû à l’électroendosmose dépend de :
ü la nature du support
ü la force ionique
ü pH du tampon.
2. Phénomènes d’évaporation
Le passage du courant électrique entraîne par effet Joule, un dégagement de chaleur qui provoque l’’évaporation de la solution d’électrolytes àon a ainsi une modification du la migration électrophorétique.
3. Phénomènes de diffusion
Conformément à la loi de Fick, les particules ont tendance à diffuser des régions où elles sont à la plus forte concentration vers les concentrations plus faibles.
4. Électrolyse
Ce courant s’établit lorsqu’il y a modification de la composition du tampon dans les compartiments des électrodes à la suite de la décharge des ions sur les électrodes.
APPAREILLAGE
Compte tenu de la variété des appareils d’électrophorèse, il est impossible de tous les décrire. On retrouve cependant, toujours 3 éléments principaux
ü le générateur,
ü la cuve,
ü les électrodes.
ü Support
En plus : Support, solution tampon.
1. Le générateur
Il est relié aux 2 électrodes de la cuve électrophorétique. On utilise un courant :
ü Soit en tension stabilisée 0 < V < 500V
ü Soit à intensité stabilisée U< 1 < 200 Ma
ü Soit à puissance constante 0 < P < 400 W
Le choix se fera en fonction de :
ü La technique électrophorétique
ü la nature du support (évaporation ou non)
2. La cuve
Les cuves doivent être fermées et saturées en vapeur de solvant, de façon à minimiser les phénomènes d’évaporation par effet Joule.
Les électrophorèses sur papier ou acétate de cellulose se pratiquent à l’aide de cuves dans lesquelles les supports sont maintenus à l’horizontale.
Les électrophorèses en gel de polyacrylamide et les focalisations isoélectriques peuvent se pratiquer soit :
ü en plaques horizontales
ü en plaques verticales.
ü Ou encore à l’intérieur d’un tube en verre.
3. Les électrodes
Elles sont en :
ü Graphite
ü ou en platine.
Afin d’établir un circuit électrique fermé, on relie les électrodes entre elles par une solution conductrice d’ions (tampon).
4. Support :
Acétate de cellulose : séparation grossière (protéines)
Papier (amidon) : abandonné car dépôts+++ (aa et petites molécules)
PAA : sépare les protéines et acides nucléiques (support électriquement inerte)
Agarose : se gélifie à bord : grande précision (protéines, ac. nucléique, molécules de grande taille)
TECHNIQUES ELECTROPHORETIQUES
§ Électrophorèse en veine liquide : Ou électrophorèse de frontière (A titre historique)
§ Électrophorèse en milieu hétérogène :
1. Electrophorèse de zone ou sur support) +++
L’électrophorèse de zone ou sur support est d’un usage quotidien en biologie clinique pour l’étude des fractions protéiques du sérum.
Le milieu liquide dans lequel s’effectue la migration est stabilisé par un support de nature varié sur lequel il est ensuite plus aisé de localiser les différentes zones de migration.
Ce procédé permet d’obtenir d’excellentes séparations : ne nécessite que de très faibles quantités d’échantillons.
Nature du support
ü acétate de cellulose
ü Agarose
ü gels de polyacrylamide
2. Électrophorèse en gradient de densité
A l’aide d’un créateur de gradient, on peut réaliser un gel de porosité linéairement croissante.
En faisant migrer un mélange protéique dans un tel gel, dans le sens des porosités décroissantes, chaque sous unité protéique se trouvera arrêtée à l’endroit où les pores du gel seront devenus trop petits pour que la protéine continue à migrer.
On peut ainsi séparer les entités protéiques selon leur masse moléculaire et augmenter la résolution par rapport à l’électrophorèse conventionnelle.
3. Electrofocalisation ou focalisation isoélectrique
Dans ce cas le PH n’est pas maintenu constant dans l’ensemble du système, mais les composants de l’échantillon migrent par électrophorèse dans un gradient stationnaire de PH. Ainsi ils sont concentrés ‘focalisés) en bandes étroites à leur points isoélectriques respectifs
4. Électrophorèse en gel de polyacrylamide en présence de dodécylsulfate de sodium (SDS-PAGE)
Le SDS combiné à celle d’un réducteur de liaisons sulfure à température élevée (100°C – 1 à 2 min) dissocie (dénature) les agrégats protéiques.
Le SDS se fixe sur les polypeptides selon un rapport constant et les transforment en anions.
Les complexes SDS-polypeptides ont donc des charges identiques (quel que soit le polypeptide) et migrent donc exclusivement en fonction de leur taille moléculaire.
Cette technique permet donc une estimation des masses moléculaires des peptides.
5. Électrophorèse bidimensionnelle
Divers systemes bidimensionnels ont été utilisés, le + frequent est de realiser 2 migrations consécutives dans deus directions perpendiculaires avec 2 tampons differents(par ex electrofocaalisation et electrophorese sur gel PAA-SDS)
6. Électrophorèse capillaire
Technique de séparation électrocinétique effectuée dans un tube de diamètre inférieur à 100 µm rempli d’un milieu électrolyte.
Les modes de déplacement des solutés sont l’électromigration et l’électro-osmose.
Il existe 3 modes de séparation :
ü Electrophorèse capillaire en solution libre où la séparation se fait en fonction de leur charge au sein d’un électrolyte aqueux;
ü Chromatographie capillaire électrocinétique en présence de micelles où la séparation se fait en fonction de leur charge et de leur hydrophobicité au sein d’un électrolyte contenant des micelles d’un surfactant;
ü Electrophorèse capillaire sur gel où les composés sont séparés au sein d’un gel (polyacrylamide par exemple).
Cette technique présente de nombreux avantages* :
ü Très grand pouvoir séparateur
ü Très haute sensibilité
ü Rapidité d’analyse
ü Bon aspect quantitatif des analyses
7. Electrophorèse en champs pulsé :
Pour réparer les molécules de haut poids moléculaire, exemple : ADN : changement périodique du sens du champs électrique.
8. Techniques immunoélectrophorétiques
Elles couplent une migration électrophorétique et une méthode de précipitation antigène- anticorps en milieu gélosé
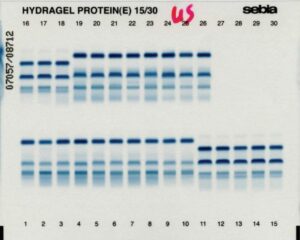
9. Immunofixation
Méthode de détection immunologique qui permet par précipitation de mise en évidence et de typer une Immunoglobines monoclonale dans le sérum ou les urines d’un patient.
Tend actuellement à supplanter l’immunoélectrophorèse .
Permet d’identifier des anticorps (des immunoglobulines monoclonales) dans un mélange, en fonction de leur mobilité électrophorétique. L’immunofixation s’effectue à l’aide d’un antisérum pentavalent.
TECHNIQUES DE REVELATION
Selon la nature des fractions à mettre en évidence et le support employé, de nombreux procédés peuvent être utilisés.
La révélation peut se faire par des colorants, par une méthode physique ou après transfert et empreinte.
1. Imprégnation de réactifs colorants
Noir amide, rouge Ponceau, amido-schwartz … : colorent d’une manière égale les différentes fractions de protéines.
L’intensité des tâches ainsi obtenues est évaluée par découpage, élution et lecture photométrique ou par densitométrie.
2. Observation sous lumière UV
3. Autoradiographie directe
4. Techniques de transfert et d’empreinte (techniques de blotting)
Pour le transfert, on utilise les de nylon ou accessoirement de nitrocellulose qui retiennent les protéines ou les acide nucleiques par liaison électrostatique ou covalente.
La révélation se fait immunodétection ou par hybridation de sonde analogue .
Cette technique s’applique aux enzymes, hormones, ADN, ARN, oncogènes, allergènes
APPLICATIONS
Les applications de l’électrophorèse sont multiples en biologie.
Elles sont surtout qualitatives mais elles peuvent être quantitatives .
Exemple : Si la séparation aboutit à des zones bien distinctes, elles peuvent être isolées par découpage du support permettant le dosage (exemple : par lecture d’absorbance après élution).
1. Électrophorèse sur acétate de cellulose
ü Protéines sériques;
ü Lipoprotéines sériques ;
ü Protéines urinaires (après concentrations) ;
ü Protéines du LCR (après concentrations) ;
ü Hémoglobines sanguines.
2. Électrophorèse sur agarose
ü Exploration des dysprotéinémies,
ü recherche des protéines de Bence-Jones
3. Électrophorèse sur gel de polyacrylamide
ü Lipoprotéines ;
ü Hémoglobines sanguines;
ü Protéines du LCR ;
ü ADN et ARN
4. Focalisation isoélectrique
ü Haptoglobines ;
ü Apolipoprotéines E ;
CONCLUSION
Ce sont des techniques très utilisées en routine et dans la recherche.
Présentent un intérêt majeur dans le diagnostic des gammapathies monoclonales, hémoglobinopathies.